Εργαστήριο Αναπτυξιακής & Αναπαραγωγικής Βιολογίας
- Κτήριο Ε2
- (Iσόγειο)
- Email Εργαστηριου: pmaragos@uoi.gr
- Email Εργαστηριου: 2651007344
Σύντομη περιγραφή του Εργαστηρίου
Η διαδικασία της Mείωσης στα γαμετικά κύτταρα των θηλαστικών ξεκινά στις ωοθήκες πριν από τη γέννηση.
Ο συνολικός αριθμός των ωοκυττάρων εμφανίζονται στις ωοθήκες κατά τη διάρκεια της εμβρυογένεσης όταν τα γαμετικά κύτταρα εισέρχονται στη μείωση και παραμένουν ακινητοποιημένα στην Πρόφαση. Η κατάσταση ακινητοποίησης της πρόφασης μπορεί να διαρκέσει για χρόνια, και στον άνθρωπο, η κατάσταση ακινητοποίησης μπορεί να διαρκέσει έως και 50 χρόνια. Από την εφηβεία, τα ωοκύτταρα λαμβάνουν ορμονικά ερεθίσματα για να αναπτυχθούν και να αποκτήσουν την ικανότητα να επανεκκινήσουν τη Μείωση. Αυτή η παρατεταμένη κατάσταση ακινητοποίησης καθιστά τα ωοκύτταρα εξαιρετικά ευαίσθητα στη συσσώρευση περιβαλλοντικών ή ενδογενών προσβολών, που μπορεί να επηρεάσουν τη γενετική ακεραιότητα των θηλυκών γαμετών και επομένως τη γενετική ακεραιότητα του μελλοντικού εμβρύου. Επιπλέον, μια μακροχρόνια κατάσταση ακινητοποίησης επηρεάζει τη φυσιολογία και τη δυναμική των ωοκυττάρων που οδηγούν στην ηλικιακά-εξαρτώμενη υπογονιμότητα.
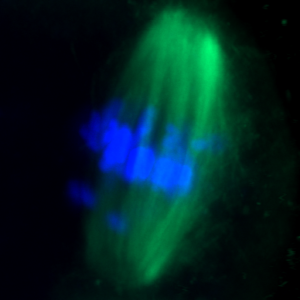
Η γονιμότητα και η φυσιολογική ανάπτυξη του εμβρύου εξαρτάται σε μεγάλο βαθμό από τη σωστή ρύθμιση του κυτταρικού κύκλου κατά τη διάρκεια της γαμετογένεσης και της πρώιμης εμβρυικής ανάπτυξης. Η ομάδα μας ασχολείται με τη μελέτη της ρύθμισης του κυτταρικού κύκλου και την απόκριση σε βλάβες του DNA κατά τη διάρκεια της ανάπτυξης του ωοκυττάρου και του πρώιμου εμβρύου στα θηλαστικά.
Οι ερευνητικές δραστηριότητες του Εργαστηρίου Αναπτυξιακής & Αναπαραγωγικής Βιολογίας συνοψίζονται στα εξής:
- Μελέτη του κυτταρικού κύκλου ωοκυττάρων, ωαρίων και προ-εμφυτευτικών εμβρύων θηλαστικών.
- Μελέτη της απόκρισης ωοκυττάρων, ωαρίων και προ-εμφυτευτικών εμβρύων σε βλάβες του DNA.
- Προσδιορισμός του ρόλου και της λειτουργίας ωοκυτταρικών ρυθμιστών που παρουσιάζουν και ογκογονική έκφραση.
- Μελέτη των μηχανισμών της γήρανσης ωοκυττάρων και της σχέσης της με χρωμοσωμικές ανωμαλίες, ανευπλοειδία και βλάβες του DNA.
- Εξέταση των επιπτώσεων διατροφικών και αγχωδών διαταραχών στην ανάπτυξη των ωοκυττάρων.
Έρευνα
Απόκριση σε βλάβες του DNA και αναπαραγωγική γήρανση
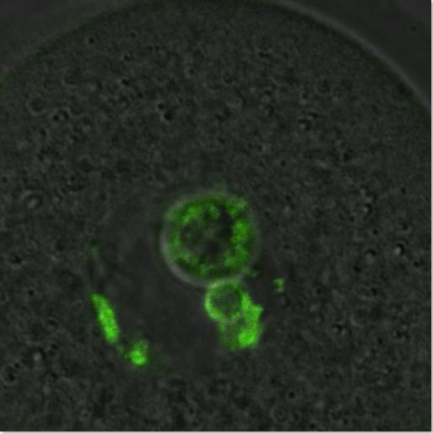
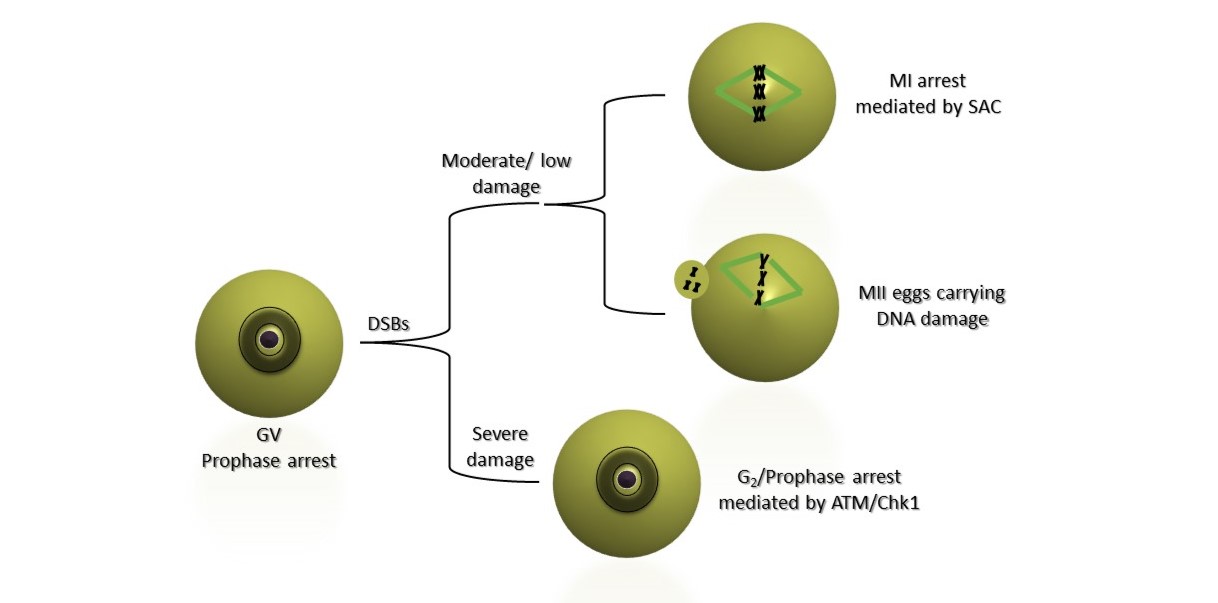
Η αυξανόμενη τάση των σύγχρονων γυναικών να αναβάλλουν την τεκνοποίηση έχει οδηγήσει σε αύξηση της υπογονιμότητας, στην ανάπτυξη κυήσεων με χρωμοσωμικές ανωμαλίες και στην αύξηση της αναζήτησης θεραπειών υποβοηθούμενης αναπαραγωγής. Η προχωρημένη αναπαραγωγική ηλικία της μητέρας έχει αποδειχθεί πως αποτελεί κεντρικό παράγοντα κινδύνου για γονιδιωματική αστάθεια. Ως βασική αιτία εμφάνισης χρωμοσωμικών ανωμαλιών αναδεικνύεται πλέον και η αναποτελεσματική απόκριση σε βλάβες του DNA στα ωοκύτταρα. Στο εργαστήριό μας έχουμε ανακαλύψει ότι, αν και τα νεαρά ωοκύτταρα δεν διαθέτουν ισχυρό σημείο ελέγχου βλάβης του DNA της φάσης G2, αναπτύσσουν σημείο ελέγχου στη βλάβη του DNA κατά την πρώτη μειοτική φάση Μ. Αυτή η απόκριση εξαρτάται από την ενεργοποίηση του σημείου ελέγχου της ατράκτου αλλά και από άλλους σημαντικούς ρυθμιστές του κυτταρικού κύκλου όπως το μονοπάτι Mos/MAPK.
Ωστόσο, τα ηλικιωμένα ωοκύτταρα δεν παρουσιάζουν ισχυρή απόκριση στη βλάβη του DNA κατά τη διάρκεια της μείωσης λόγω αναποτελεσματικού σημείου ελέγχου της ατράκτου. Στα πλαίσια της ερευνητικής μας δραστηριότητας, εξετάζουμε την απόκριση σε βλάβες στο DNA με έμφαση στους μηχανισμούς επιδιόρθωσης του DNA σε νεαρά και ηλικιωμένα ωοκύτταρα ποντικού και ανθρώπου. Η μελέτες αυτές θα επιτρέψουν τον προσδιορισμό των επιπτώσεων των βλαβών του DNA στην ωοκυτταρική μείωση, τη γονιμοποίηση και την ανάπτυξη των εμβρύων και θα αναδείξει πιθανές αιτίες ανθρώπινης υπογονιμότητας.
Ρύθμιση του κυτταρικού κύκλου των ωοκυττάρων
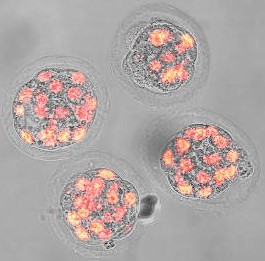
Ένα από τα κεντρικά ερευνητικά αντικείμενα στα οποία εστιάζει το εργαστήριό μας είναι ο προσδιορισμός του ρόλου διαφορετικών ρυθμιστών του κυτταρικού κύκλου κατά τις μειωτικές διαιρέσεις των ωοκυττάρων του ποντικού. Εξετάζουμε συγκεκριμένα, πώς οι ρυθμιστές του κυτταρικού κύκλου ελέγχουν την παρατεταμένη φάση ακινητοποίησης της Πρόφασης σε αναπτυσσόμενα και πλήρως αναπτυγμένα ωοκύτταρα. Επιπλέον, διερευνούμε τον ρόλο πρωτεϊνών του κυτταρικού κύκλου στην πορεία της φάσης Μ της μείωσης και στην επιτήρηση του σωστού διαχωρισμού των χρωμοσωμάτων. Ανιχνεύουμε επίσης πώς αυτές οι διαδικασίες σχετίζονται με την διαίρεση των βλαστοκυττάρων του προεμφυτευτικού εμβρύου.
Στο παρελθόν, ο επικεφαλής του εργαστηρίου, καθηγητής Πέτρος Μαραγκός, είχε καθοριστικό ρόλο στην αξιολόγηση της δυναμικής της κυκλίνης Β κατά την ωρίμανση και τη γονιμοποίηση των ωοκυττάρων, στον προσδιορισμό του ρόλου των πρωτεϊνικών παραγόντων Emi1 και Securin στη ρύθμιση της φάσης ακινητοποίησης της Προφάσης και στην ανακάλυψη ότι ο χρόνος καταστροφής υποστρωμάτων της λιγάσης APC/C εξαρτάται από την ανταγωνιστική δράση μεταξύ των υποστρωμάτων για δέσμευση στην APC/C.
Ωοκυτταρικοί ρυθμιστές του κυτταρικού κύκλου: συνδέοντας τη μείωση με τον καρκίνο

Οι μηχανισμοί που ρυθμίζουν την πορεία και επιτήρηση της φάσης Μ δείχνουν σημαντικές ομοιότητες στη μείωση και τη μίτωση. Ωστόσο, υπάρχουν ωοκύτταρο-ειδικοί παράγοντες που εμπλέκονται στον μειωτικό κυτταρικό κύκλο ή στη δομή της χρωματίνης και της ατράκτου που δεν εντοπίζονται σε φυσιολογικά σωματικά κύτταρα. Εντούτοις, ωοκύτταρο-ειδικοί ρυθμιστές όπως η κινάση Mos φαίνεται να εκφράζονται σε αρκετούς καρκίνους. Στο εργαστήριό μας, εντοπίζουμε τέτοιους παράγοντες που ενδέχεται να συμμετέχουν στη ρύθμιση της φάσης Μ σε σωματικά κύτταρα και συγκεκριμένα σε καρκινικά κύτταρα. Εξετάζουμε τη δυνητική τους λειτουργία σε σωματικά κύτταρα και ιδιαίτερα κατά τη μίτωση των καρκινικών κυττάρων.
Οι μελέτες αυτές θα προσφέρουν νέες γνώσεις για τη βαθύτερη κατανόηση της βιολογίας του καρκίνου και πιθανά να οδηγήσουν στην ανάπτυξη νέων θεραπειών για την αντιμετώπιση της νόσου. Εξετάζουμε επίσης εάν ωοκυτταρο-ειδικοί παράγοντες μπορούν να εισαχθούν στα καρκινικά κύτταρα προκειμένου να επηρεάσουν την πορεία του κυτταρικού κύκλου και κατ’ επέκταση την ογκογονική ανάπτυξη. Επιπλέον, μελετούμε το πρόβλημα της ανθεκτικότητας του καρκίνου.
Η ανθεκτικότητα του καρκίνου σε χημειοθεραπευτικούς παράγοντες μετά από παρατεταμένη έκθεση σε αυτούς, είναι ένα κρίσιμο πρόβλημα στη θεραπεία του καρκίνου. Μία βασική αιτία για την ανθεκτικότητα στα φάρμακα για τον καρκίνο είναι η αποτυχία των μιτωτικών κυττάρων που έχουν υποστεί βλάβες να διακόψουν τον κυτταρικό τους κύκλου και να πεθάνουν μέσω απόπτωσης. Στο εργαστήριό μας δοκιμάζουμε ωοκυτταρο-ειδικούς ρυθμιστές ως πιθανούς στόχους για την ανάπτυξη νέων θεραπευτικών μεθόδων για τη διατήρηση της ευαισθησίας στα φάρμακα στα καρκινικά κύτταρα.
Ωοκύτταρα, άγχος και διατροφή
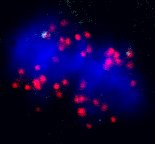
Οι αγχώδεις διαταραχές επηρεάζουν περίπου το ένα τρίτο του παγκόσμιου πληθυσμού κατά τη διάρκεια της ζωής τους και είναι εξαιρετικά συννοσηρικές με σοβαρές χρόνιες παθήσεις. Την ίδια στιγμή, περισσότεροι από 55 εκατομμύρια άνθρωποι παγκοσμίως πάσχουν από μια διατροφική διαταραχή. Είναι ενδιαφέρον ότι τα μισά από τα άτομα που έχουν διαγνωστεί με διατροφική διαταραχή υποφέρουν επίσης από αγχώδη διαταραχή, ενώ >50% των ασθενών με διατροφικές διαταραχές εμφανίζουν επαναλαμβανόμενες αγχώδεις διαταραχές. Ειδικά για τις γυναίκες, το υψηλό άγχος ή/και οι διατροφικές διαταραχές επηρεάζουν την αναπαραγωγική τους υγεία συμβάλλοντας σε υψηλότερα ποσοστά προβλημάτων γονιμότητας. Στο εργαστήριό μας διερευνούμε την αλληλεπίδραση των διατροφικών διαταραχών και των αγχωδών διαταραχών και μελετούμε τις επιπτώσεις αλλαγών των διατροφικών συνηθειών παρουσία υψηλού άγχους με επίκεντρο τα ωοκύτταρα. Εφαρμόζουμε ένα πρωτόκολλο θερμιδικού περιορισμού της τροφής σε ένα μοντέλο ποντικού με υψηλό άγχος για να διευκρινίσουμε πώς η μιτοχονδριακή λειτουργία διαμορφώνει την απόκριση των ωοκυττάρων σε διατροφικές παρεμβάσεις σε συνθήκες υψηλού άγχους και εάν ο φαρμακολογικός χειρισμός της μιτοχονδριακής δυναμικής μπορεί να ασκήσει ευεργετικά αποτελέσματα στην υπογονιμότητα που εξαρτάται από το άγχος και τη διατροφή.
Υποδομές - Τεχνογνωσία
Η ερευνητική μας ομάδα έχει πολυετή εμπειρία στον χειρισμό ωοκυττάρων και εμβρύων ποντικών in vitro. Έχουμε ένα αποδεδειγμένο ιστορικό στην εφαρμογή και ανάπτυξη τεχνικών κυτταρικής και μοριακής βιολογίας για χρήση σε αυτό το εξειδικευμένο πειραματικό σύστημα.
Το μοντέλο του ποντικού
Ο ποντικός είναι ένα εύκολα διαχειρίσημο πειραματικό μοντέλο για τη μελέτη της ανάπτυξης ωοκυττάρων και προεμφυτευτικών εμβρύων θηλαστικών. Διαθέτουμε υψηλή τεχνογνωσία στην απομόνωση, καλλιέργεια και ανάλυση ωοκυττάρων σε όλα τα στάδια ανάπτυξης και ωρίμανσης τους, και εμβρύων σε όλα τα προεμφυτευτικά στάδια.
Απεικονιστική μικροσκοπία
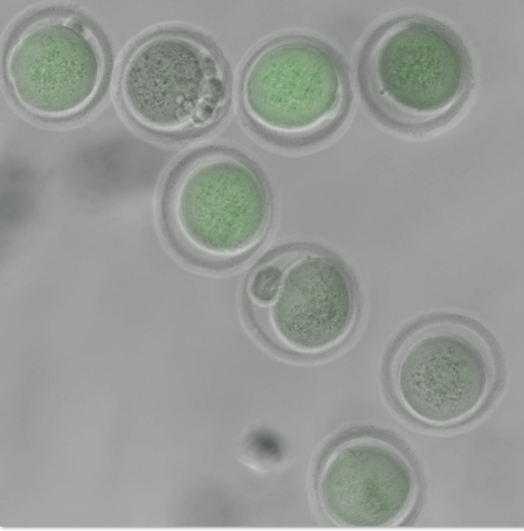
Είμαστε το μοναδικό εργαστήριο στην Ελλάδα με μεγάλη εμπειρία στη ζωντανή απεικόνιση ωοκυττάρων και του εμβρύων θηλαστικών. Χρησιμοποιούμε προσεγγίσεις που έχουμε καθιερώσει, συμπεριλαμβανομένης της χρήσης πρωτεϊνών συζευγμένων με GFP για την αξιολόγηση της δυναμικής του κυτταρικού κύκλου σε ζωντανά ωοκύτταρα και έμβρυα. Επιπλέον, διαθέτουμε την τεχνογνωσία για τη συλλογή δεδομένων σχετικά με τη διάρκεια του σταδίου του κυτταρικού κύκλου και τα ποσοστά εμβρυϊκής διαίρεσης. Επιπλέον, είμαστε ειδικοί στη συνεστιακή μικροσκοπία και την ανίχνευση και εντοπισμό δύσκολα διακριτών παραγόντων όπως οι πρωτεΐνες του κινητοχώρου.
Γονιδιακοί χειρισμοί και μικροχειρισμοί
Η υπερέκφραση πρωτεϊνών συζευγμένων με φθορίζουσες πρωτεΐνες (GFP) μέσω μικροέγχυσης mRNA, γονιδιακή αποσιώπηση μέσω RNAi και διάφορες προσεγγίσεις μικροχειρισμού ωοκυττάρων/εμβρύων, συμπεριλαμβανομένης της πυρηνικής μικροέγχυσης, αποτελούν εργαστηριακές τεχνικές ρουτίνας για το εργαστήριό μας.
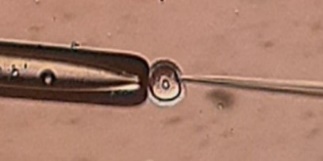
Διαθέτουμε τη μοναδική δυνατότητα να συνδυάσουμε αυτές τις τεχνικές με μικροσκοπική απεικόνιση υψηλών προδιαγραφών για να απαντήσουμε σε ερωτήματα σχετικά με τον κυτταρικό κύκλο και τις αναπτυξιακές διαδικασίες που διέπουν τα ωοκύτταρα και τα έμβρυα των θηλαστικών.
Εργαστηριακή υποδομή
Σύστημα απεικόνισης μικροσκοπίας φθορισμού ευρέως πεδίου για την παρατήρηση ζωντανών κυττάρων.

Υποδομή για την καλλιέργεια και τον μικροχειρισμό ωοκυττάρων και προεμφυτευτικών εμβρύων θηλαστικών.
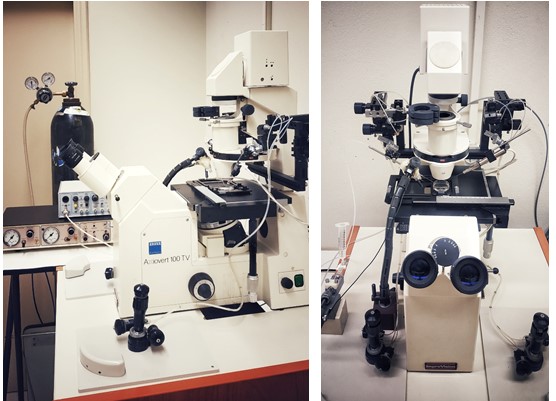
Το εργαστήριό μας είναι υπεύθυνο για τη διαχείριση και τη λειτουργία του συστήματος Συνεστιακής Μικροσκοπίας του Πανεπιστημίου Ιωαννίνων.

Δημοσιεύσεις
- Zorzompokou C., Ipeirotis M., Martzoukos M.K., Marangos, P. (correspondence). Detection of DNA Double-stranded Breaks in Mouse Oocytes. JoVE (J. Vis. Exp.) DOI: 10.3791/65494
- Pailas, A., Niaka, K., Zorzompokou, C., Marangos, P. (correspondence). The DNA Damage Response in Fully Grown Mammalian Oocytes. Cells, 2022, 11(5), 798. DOI: 3390/cells11050798
- Rémillard-Labrosse, G., Dean, N. L., Allais, A., Mihajlović, A. I., Jin, S. G., Son, W. Y., Chung, J. T., Pansera, M., Henderson, S., Mahfoudh, A., Steiner, N., Agapitou, K., Marangos, P., Buckett, W., Ligeti-Ruiter, J., & FitzHarris, G. Human oocytes harboring damaged DNA can complete meiosis I. Fertility and Sterility, 2020, 113(5), 1080–1089.e2. DOI: 1016/j.fertnstert.2019.12.029
- Gonzalez Malagon, S. G., Dobson, L., Muñoz, A. M., Dawson, M., Barrell, W., Marangos, P., Krause, M., Liu, K. J. Dissection, Culture and Analysis of Primary Cranial Neural Crest Cells from Mouse for the Study of Neural Crest Cell Delamination and Migration. JoVE (J. Vis. Exp.) 2019, (152), e60051, doi:10.3791/60051. DOI: 3791/60051
- Zhang QH, Yuen WS, Adhikari D, Flegg JA, FitzHarris G, Conti M, Sicinski P, Nabti I, Marangos P, Carroll J. Cyclin A2 modulates kinetochore-microtubule attachment in meiosis II. J Cell Biol. 2017 Aug 17. 216:3133-3143. DOI: 1083/jcb.201607111
- Nabti I, Grimes R, Sarna H, Marangos P, Carroll J. Maternal age-dependent APC/C-mediated decrease in securin causes premature sister chromatid separation in meiosis II. Nat Commun. 2017 May 18;8:15346. DOI: 1038/ncomms15346
- Marangos P (correspondence). Preparation of cell lysate from mouse oocytes for Western blotting analysis. Methods in Molecular Biology. 2016;1457:209-15. DOI: 1007/978-1-4939-3795-0_15
- Marangos P (correspondence), Stevense M, Niaka K, Lagoudaki M, Nabti I, Jessberger R and Carroll DNA damage-induced metaphase I arrest is mediated by the Spindle Assembly Checkpoint and maternal age. Nature Communications. 2015. 6:8706. DOI: 10.1038/ncomms9706
- Ibtissem Nabti, Marangos P (correspondence), Kudo N and Carroll J. Dual-mode regulation by CDK1 and MAPK controls APC activity during meiosis I in mouse oocytes. Journal of Cell Biology. 2014 March; 204(6): 891-900. DOI: 1083/jcb.201305049
- Carroll J and Marangos P (correspondence). The DNA damage response in mammalian oocytes. Frontiers in Genetics. 2013 June; 4:117. DOI: 3389/fgene.2013.00117
- Marangos P. (correspondence) Micro-injection of Morpholino oligonucleotides for depleting Securin in mouse oocytes. Methods in Molecular Biology. 2013; 957: 153-62. DOI: 1007/978-1-62703-191-2_10
- Marangos P (correspondence) and Carroll J. Oocytes progress beyond prophase in the presence of DNA damage. Current Biology, 2012 June; 22(11): 989-994. DOI: 1016/j.cub.2012.03.063
- Marangos P (correspondence) and Carroll J. Securin regulates entry into M-phase by modulating the stability of cyclin B. Nature Cell Biology, 2008 April; 10(4): 445-451. DOI: 1038/ncb1707 Supported by a News and Views article. DOI: 10.1038/ncb0408-381
- Marangos P (correspondence), Verschuren EW, Chen R, Jackson PK and Carroll J. Prophase I arrest and progression to metaphase I in mouse oocytes are controlled by Emi1-dependent regulation of APC/Cdh1. Journal of Cell Biology. 2007 Jan 1;176(1):65-75. DOI: 1083/jcb.200607070
- FitzHarris G, Marangos P and Carroll J. Changes in endoplasmic reticulum structure during mouse oocyte maturation are controlled by the cytoskeleton and cytoplasmic dynein. Developmental Biology. 2007 May 1;305(1):133-44. DOI: 1016/j.ydbio.2007.02.006
- Marangos P, Carroll J. Fertilization and InsP3-induced Ca2+ release stimulate a persistent increase in the rate of degradation of cyclin B1 specifically in mature mouse oocytes. Developmental Biology. 2004 Aug 1;272(1):26-38. DOI: 1016/j.ydbio.2004.04.012
- Marangos P, Carroll J. The dynamics of cyclin B1 distribution during meiosis I in mouse oocytes. 2004 Aug;128(2):153-62. DOI: 10.1530/rep.1.00192
- Dumollard R, Marangos P, Swann K, Duchen M and Carroll J. Sperm-triggered Ca2+ oscillations and Ca2+ homeostasis in the mouse egg have an absolute requirement for mitochondrial ATP production. 2004 Jul;131(13):3057-67. DOI: 10.1242/dev.01181
- Carroll J, FitzHarris G, Marangos P, Hallet G. Ca2+ signalling and cortical re-organisation during the transition from meiosis to mitosis in mammalian oocytes. Eur J Obstet Gynecol Reprod Biol. 2004 Jul 1;115 Suppl 1:S61-7. DOI: 1016/j.ejogrb.2004.01.024
- Marangos P., FitzHarris G. and Carroll J. Ca2+ oscillations at fertilization in mammals are regulated by the formation of pronuclei. Development. 2003 Apr 1; 130(7):1461-1472. DOI: 1242/dev.00340
- Halet G, Marangos P, FitzHarris G, Carroll Ca2+ oscillations at fertilization in mammals. J. Biochem Soc Trans.2003 Oct; 31(Pt 5):907-11 DOI: 1042/bst0310907
- FitzHarris G, Marangos P and Carroll J. Cell Cycle-dependent regulation of structure of endoplasmic reticulum and inositol 1,4,5-trisphosphate-induced Ca2+ release in mouse oocytes and embryos. Molecular Biology of the Cell. 2003 Jan;14(1):288-301 DOI: 1091/mbc.e02-07-0431
- Christian M, Marangos P, Mak I, White J and Brosens J. Interferon-gamma modulates prolactin and tissue factor expression in differentiating human endometrial stromal cells. Endocrinology. 2001 Jul;142(7):3142-51 DOI: 1210/endo.142.7.8231
Μέλη εργαστηρίου
(Πρόεδρος Τμήματος)